G蛋白偶联受体(G protein-coupled receptors,GPCRs)作为基因组中最大的膜蛋白家族,是药物开发领域的“明星”。据统计33%药物靶向GPCR,目前有21种靶向不同14种GPCR的抗癌药物已经获得批准。自上世纪90年末,陆续发现生理活性磷脂受体以来,从脂质受体中寻找新的小分子治疗靶点已成为生物医学研究的热点领域。近期,重点实验室阿拉坦高勒教授课题组在该领域研究中得到新进展。
团队博士研究生闫亚丽在生物学领域国际知名学刊期刊Biochimica ET Biophysica Acta (BBA) - Molecular Basis of Disease(中科院生物学大类二区Top,IF:6.633)上发表题为 “NF-kappaB and EGFR participate in S1PR3-mediated human renal cell carcinomas progression”的研究论文,报道了鞘氨醇1-磷酸(sphingosine 1-phosphate,S1P)及其受体在肾癌发展中的作用及机制。S1P被认为是许多生理和病理过程的重要调节因子,包括癌症、动脉粥样硬化、糖尿病等。该研究发现,S1P通过S1PR3/Gi/p38/Akt/p65/cyclin D1-CDK4通路促进肾癌细胞增殖,通过S1PR3/Gi/q/ERK/p38/p65促进肾癌细胞迁移;S1PR3通过提高p65的表达水平以强化其调控强度,并激活NF-κB信号通路促进炎症因子的表达。并揭示S1PR3通过上调EGFR的表达,而非EGFR反式活化方式来强化EGF促肿瘤发展的新机制。因此,S1PR3有望成为表达S1PR3癌症的新型小分子靶点。博士生闫亚丽和格根图雅为本文共同第一作者,阿拉坦高勒教授为通讯作者。
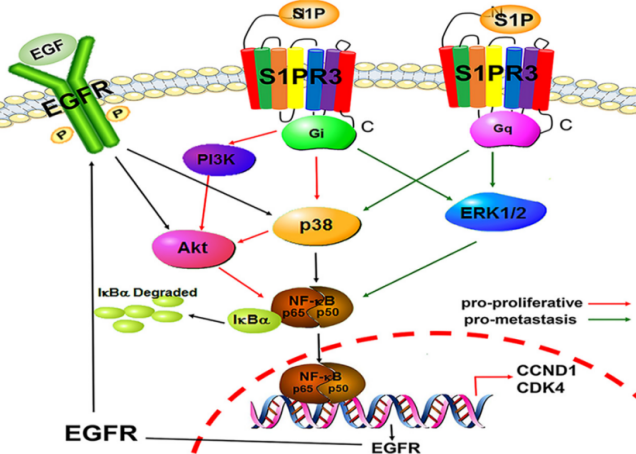
原文链接:https://www.sciencedirect.com/science/article/abs/pii/S0925443922000710?via%3Dihub
DOI:10.1016/j.bbadis.2022.166401
团队在溶血磷脂酸受体与肿瘤中作用研究也有了新的进展。自博士研究生赵鹏飞等确定了血磷脂酸受体1(LPAR1)为小细胞肺癌中的一个精准治疗靶点(LPA receptor1 antagonists as anticancer agents suppress human lung tumours,zhao et.al Eur J Pharmacol. 2020 )后,今年又发现LPAR3在卵巢癌发展中发挥重要作用。在卵巢癌中,LPAR3是6种LPA受体的唯一差异表达的LPA受体,尤其重要的是LPA通过LPA3/Gi/MAPKs/NF-κB信号通路促进卵巢癌的生长与肺转移作用。因此LPA3可能是卵巢癌中的一个新型潜在的疗靶点和生物标志物。该研究成果以“LPA3 is a precise therapeutic target and potential biomarker for ovarian cancer”为题,在肿瘤学领域国际期刊《Medical Oncology》(中科院大类三区,IF:3.738)上发表。博士生赵鹏飞为本文第一作者,阿拉坦高勒教授为通讯作者。
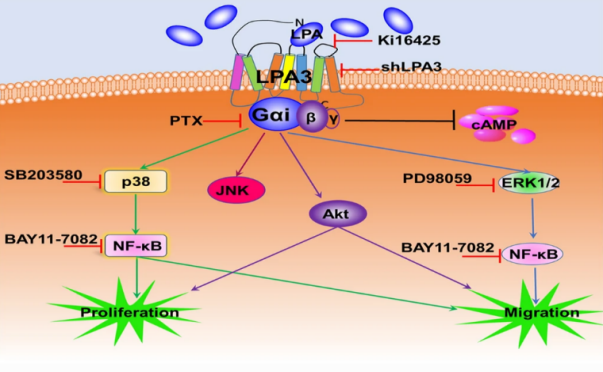
原文链接:https://link.springer.com/article/10.1007/s12032-021-01616-5
DOI: 10.1007/s12032-021-01616-5
博士研究生王跃武等在LPAR2在肾癌研究中发现,LPA通过LPAR2促进肾癌细胞增殖、克隆形成和迁移;LPAR2介导激活MAPK和NF-κB及其下游IL6、CXCL8和TNF等促炎因子的表达。生物信息学分析和临床组织芯片分析说明,LPAR2有潜在的肾癌临床诊断biomarker价值,也可能是一个潜在的肾癌治疗靶点。该研究成果以“LPAR2-mediated action promotes human renal cell carcinoma via MAPK/NF-κB signaling to regulate cytokine network”为题,在肿瘤学领域国际期刊《Journal of Cancer Research and Clinical Oncology》(中科院大类三区,IF:4.322)上发表。博士生王跃武和齐志敏为本文第一作者,阿拉坦高勒教授为通讯作者。
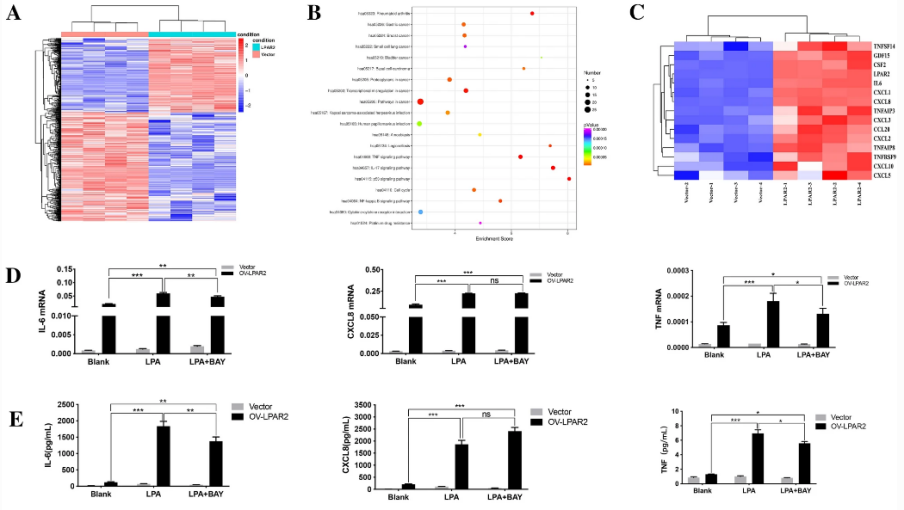
原文链接:https://link.springer.com/article/10.1007/s00432-022-04197-6#Fun
DOI: 10.1007/s00432-022-04197-6
以上研究由国家自然基金面上项目(31971219)和内蒙古自治区草原牲畜繁殖调控与育种国家重点实验室科技重大项目的支持。

阿拉坦高勒教授实验室部分博士生和博士